华夏源类器官:《Nature》子刊_人脑类器官揭示衰老与帕金森病关联
【摘要】
近年来,越来越多的研究关注点开始将神经胶质相关基因与帕金森病联系起来。美国纽约干细胞研究所的科研团队在《Nature Communications》(影响因子IF=11.9)发表研究论文[1],他们利用人类中脑类器官模型,揭示了星形胶质细胞在神经细胞衰老与帕金森病中的关联作用。研究指出星形胶质细胞功能障碍、糖基化和广泛的蛋白质聚集是家族性DJ1相关帕金森病的基本特征,并为开发更有效的神经退行性疾病治疗方法提供了策略。
衰老被认为是罹患帕金森病等神经退行性疾病的最强风险因素。
伴随着全球人口老龄化趋势的加剧,帕金森病的发病率也在逐年攀升。根据流行病学报告显示,65岁以上中国老人的帕金森病发病率为1.7%,这意味着平均每1000个老年人中就有17位是帕金森病患者。
面对发病机制复杂的帕金森病,有研究发现,或与脑内多巴胺神经元的退化有关,也涉及遗传和环境因素。
近年来,研究者们发现,细胞老化过程中的糖基化作用,尤其是高级糖基化终产物(AGEs)的积累,可能参与了帕金森病病理的关键进程。
研究人员就此提出了假设——糖基化终产物的积累会导致蛋白质降解、修复系统负担过重而引发损害,最终造成蛋白质稳态失败。
近日,美国纽约干细胞研究所的科研团队在《Nature Communications》杂志上发表了相关论文。他们利用人脑类器官揭示了星形胶质细胞在神经细胞衰老与帕金森病中的关联作用,并试图探寻帕金森病创新治疗方案。

△ 人脑类器官揭示衰老与帕金森病关键联系,或将开启治疗帕金森病新篇章。
研究人员在人脑类器官中发现,在调节缺乏帕金森病相关蛋白质(DJ1)时,星形胶质细胞中的蛋白质会发生功能异常。DJ1功能丧失会导致溶酶体功能异常,致病的突触核蛋白聚集增加并引起神经元细胞死亡。
该研究还指出星形胶质细胞功能障碍、糖基化和广泛的蛋白质聚集是家族性DJ1相关帕金森病的基本特征,并为开发更有效的神经退行性疾病治疗方法提供了策略。
01
人类大脑类器官:
研究帕金森病的“绝佳场所”
帕金森病(Parkinson’s disease,PD)是一种常见的神经退行性疾病,这种疾病直接的病因是患者大脑中负责运动控制的中脑多巴胺神经元大量死亡,从而引发运动功能受损、肢体僵硬颤抖,甚至彻底失去运动能力和智力。
PD的平均发病年龄为60岁左右,是典型的与衰老有关的神经退行性疾病之一(另一个是阿尔茨海默病,俗称“老年痴呆”)。研究衰老的生物学机制如何与神经退行性疾病进展的相互关联,是一个具有巨大医疗潜力的活跃研究领域。
近年来,“糖基化”作为一种疾病驱动机制,成为人们关注的焦点。
糖基化反应是生物体中一种常见的化学反应,涉及到糖类与其他分子的结合,形成糖基化终产物(advanced glycation end products, AGEs)。这种反应在体内自然发生,但当它过度或异常时,可能会对蛋白质结构和功能造成损害,这个过程与多种疾病的发展有关,包括糖尿病、心血管疾病和老年相关疾病。
众所周知,晚期糖基化终产物(AGEs)在核苷酸、脂质和蛋白质上的积累会损害细胞功能,同时这也是一个正常的、不可阻止的衰老特征。AGEs能够损害细胞功能,导致蛋白质质量控制机制的紊乱,进而影响神经元的生存。
在帕金森病患者的大脑中,最引人注目的病理表现是神经细胞中一种名为α-突触核蛋白(α-synulcein)的蛋白质大量聚集、形成沉淀。这种名为“路易小体”(Lewy Body)的沉积物,被认为是推动神经细胞走向死亡的直接原因。
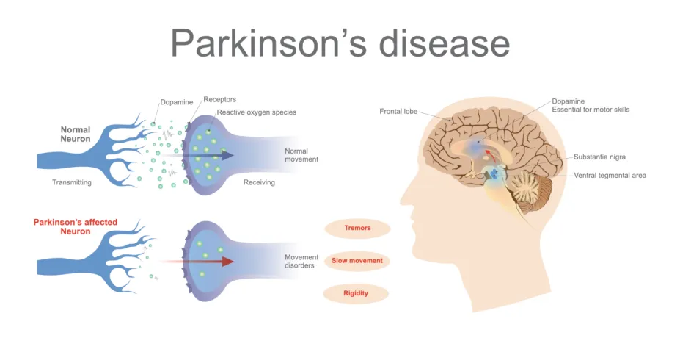
蛋白DJ1,也被称为帕金森病蛋白7,是由一种PARK7基因编码的蛋白质。通过功能丧失(LOF)突变,DJ1与早发性PD的发展存在因果关系。然而,DJ1功能的降低如何促进PD发病机制尚不清楚。
在本项研究中,研究人员为了模拟DJ1功能丧失(LOF)对中脑帕金森病病理学的影响,通过诱导多能干细胞(iPSC)衍生的人类中脑类器官(hMIDO)模型,并利用一套全面的检测方法来研究了源自患者的人脑组织和DJ1 LOF类器官iPSC模型的代谢功能。
中脑中α-突触核蛋白(α-syn)的聚集是帕金森病的标志。研究发现,DJ1基因敲除(KO)人类中脑类器官(hMIDO)在不同发育阶段的α-syn和自噬表型的异常。
在第200天,DJ1 KO中脑类器官中,星形胶质细胞表达急剧增加,单体磷酸化α-syn的水平显著增加,表明了α-syn的异常积累。
由于溶酶体途径对于多种形式的自噬至关重要,并且已知其可处理α-syn单体和聚集体,因此研究人员通过抑制溶酶体酸化来阻断溶酶体活性,结果发现自噬系统无法补偿DJ1 KO hMIDO中更高一代的聚集体,总体上导致了寡聚α-syn的积累。
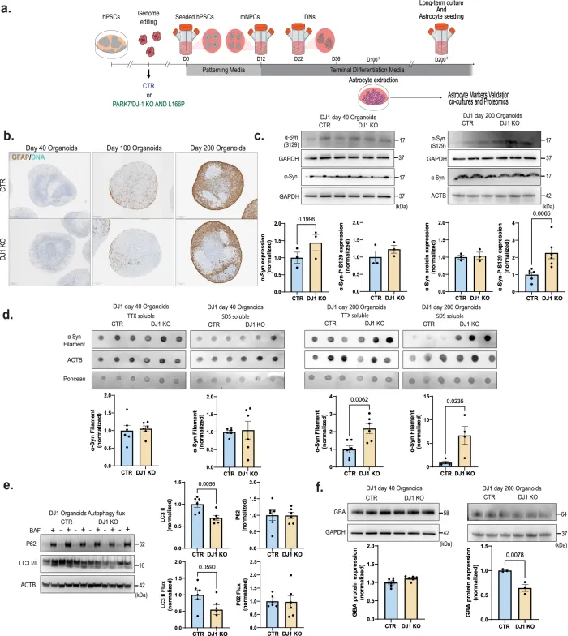
△ DJ1 KO人中脑类器官α-syn和自噬表型。
这些结果表明,DJ1功能的缺失导致了α-syn的异常磷酸化和聚集,这与PD的病理特征相符。
由于氧化损伤会损害蛋白质组的稳定性和细胞活力,并且通过晚期糖基化终产物(AGE)的积累可以驱动神经退行性变。研究发现,与对照组相比,DJ1基因敲除(KO)人中脑类器官(hMIDO)在第100天和第200天的MGH(甲基乙二醛衍生的氢咪唑酮,这是一种最初的高级糖化修饰)水平显著升高,这表明了糖基化损伤的增加。
结果表明AGEs的积累可能影响α-syn的丰度和磷酸化状态,从而在PD的发病机制中发挥作用。
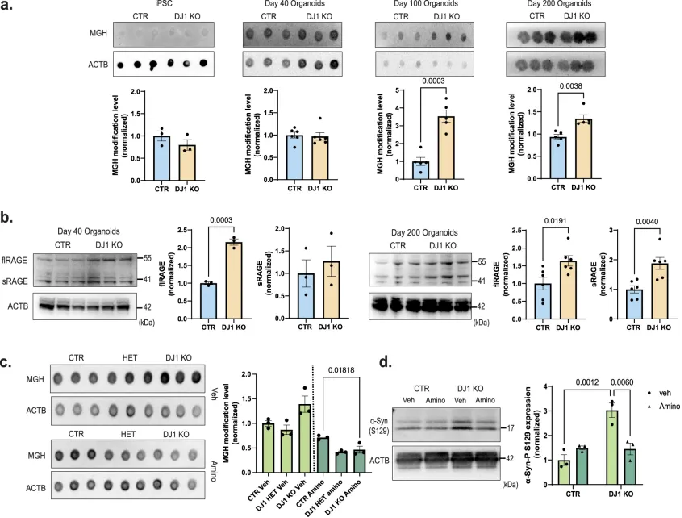
△ DJ1 KO中脑类器官增加蛋白糖基化。
星形胶质细胞是大脑中主要的糖酵解细胞类型,因此比神经元和其他脑细胞类型遭受糖化损伤的风险更高。
由于星形胶质细胞对于神经元稳态和神经元来源的受损脂质和蛋白质的降解至关重要,因此研究人员接下来分析了中脑类器官中星形胶质的细胞功能。分析结果表明DJ1在星形胶质细胞中具有显著的神经保护作用,并且PD相关的DJ1 LOF变异通过星形胶质细胞会导致神经变性。
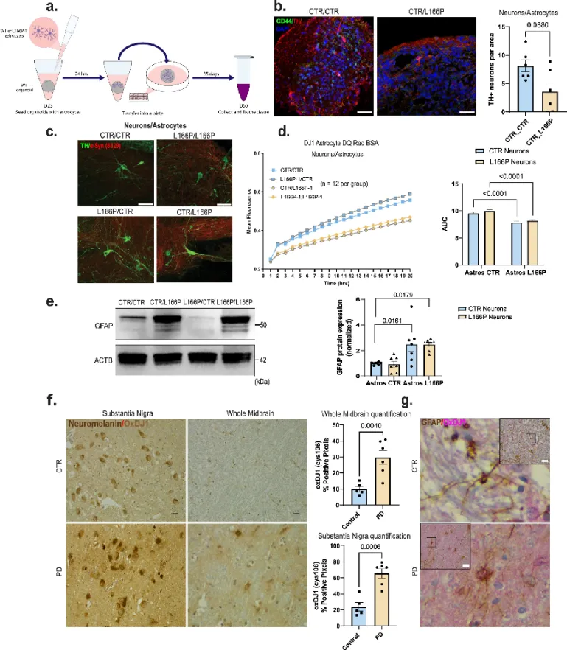
△ 星形胶质细胞DJ1 LOF具有反应性,在中脑中产生毒性。
进一步研究发现,蛋白质组不稳定性会导致星形胶质细胞的炎症、反应性和细胞因子释放。
由于聚集蛋白的降解(定义为自噬通量)在神经退行性疾病的早期阶段上调。因此,研究人员试图确定DJ1 LOF星形胶质细胞中观察到的蛋白质聚集体的积累是否是由于自噬受损或自噬通量增加的能力降低所致。结果发现,与对照组相比,DJ1 KO组核周内切酶/溶酶体有所减少,并且星形胶质细胞中的蛋白水解受损。
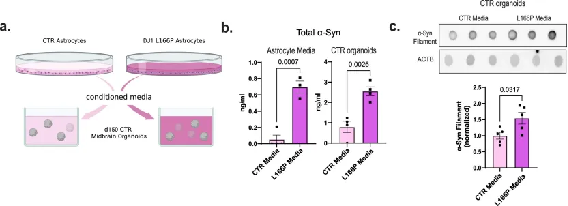
△ 星形胶质细胞 DJ1 功能丧失条件培养基导致中脑类器官的 α-syn 增加。
该数据表明,DJ1 功能丧失会降低溶酶体能力,导致有毒形式的突触核蛋白积累并增加神经元细胞死亡。
综上,本研究通过iPSC衍生人类中脑类器官进而研究帕金森病,为理解PD的发病机制提供了新见解。研究表明,星形胶质细胞功能障碍、糖化和广泛的蛋白质聚集是家族性 DJ1 相关 PD 的基本表型,为开发更有效的神经退行性疾病治疗方法指明了策略。
02
再生医学开启
神经退行性疾病治疗新篇章
由于类器官可以高度模拟体内组织或器官的生理环境,提供了一个更为贴近生物体的研究平台,加之其高度定制化、传代稳定性、可长期稳定培养等特性,人类中脑类器官模型成为帕金森病病理学长期研究和药物筛选的理想模型。
在本项研究中,科学家利用再生医学的前沿技术,结合类器官模型的可扩展性和稳定性,揭示了星形胶质细胞在衰老和帕金森病中的致病作用,以寻求潜在治疗策略,造福更多PD患者。
近年来,越来越多的研究关注点开始将神经胶质相关基因与帕金森病联系起来。这也为用细胞疗法治疗帕金森病、阿尔茨海默病等因衰老引起的神经退行性疾病,提供了可借鉴的新思路。
细胞疗法与帕金森病
早在2020年,《新英格兰医学杂志》(NEJM)曾报道了利用个性化iPSC衍生的多巴胺神经元进行个性化治疗策略的研究[2]。
在这里,研究者对一名69岁的特发性帕金森患者分别进行了2次iPSC干细胞移植,在第一次(左)植入后 24 个月和第二次(右)植入后 18 个月,患者报告没有不良事件或功能下降。
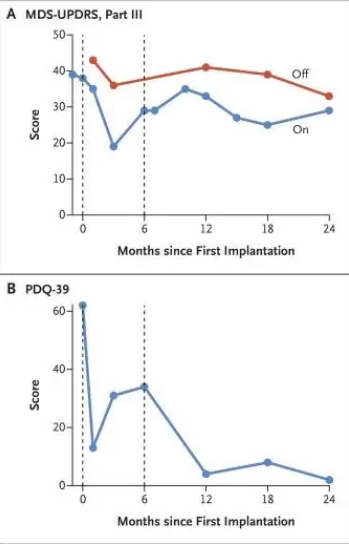
△ 帕金森病相关运动功能和生活质量的纵向临床评估。
在干细胞移植2年多以后,没有发生严重的副作用,并且病症趋于稳定,甚至有好转。
研究表明干细胞治疗可替换在疾病过程中丢失的特定多巴胺神经元,成为极具前景的治疗途径。
细胞疗法与阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease,AD)作为常见的神经退行性疾病,一直以来的研究重点几乎都与β淀粉样蛋白(Aβ)斑块与Tau蛋白导致的神经缠结有关。
不过,Aβ斑块与神经缠结并非阿尔茨海默医生当初的所有发现,他曾在样本描述中指出,患者大脑中的胶质细胞内部存在脂质小囊。不过,这种胶质细胞与脂质(glial-lipid)的病理特征并没有受到太多的关注。
在今年3月的《Nature》杂志上发表了一项重磅研究[3]。研究团队发现了一种由脂滴相关酶ACSL1定义的小胶质细胞状态。
根据论文,那些基因型为APOE4/4的患者,表达ACSL1的小胶质细胞数量更高,并且AD发生的遗传风险与小胶质细胞的脂滴(lipid droplet)累积存在联系,该发现或将为AD疗法带来全新的治疗靶点和策略。
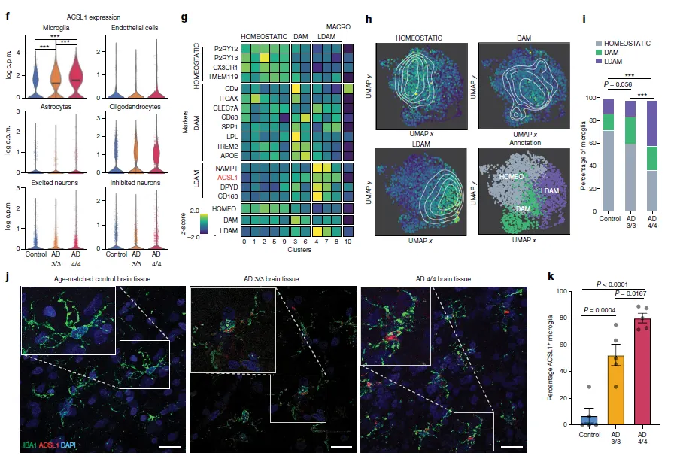
△ 研究发现了一类特殊的小胶质细胞,其表达ACSL1且脂质合成活跃。
在神经退行性疾病的治疗中,以干细胞疗法为主的再生医学表现出了新的希望和治疗策略。利用干细胞衍生的类器官模型,更是为神经退行性疾病发病机制、药物筛选及个性化治疗提供了优秀的体外场所。随着科研技术的不断深入,更多科学试验的结果陆续呈现,未来将有更多的数据来验证这些治疗的安全性和有效性,也为神经退行性疾病的患者提供更有效的治疗方案。
Write in the last
写在最后
除了传统的药物治疗,科研人员正在探索免疫疗法、干细胞治疗、纳米材料制剂治疗等新疗法来对抗帕金森病。虽然帕金森病目前无法完全治愈,但这些新疗法无疑为患者带来更可行、更有效的治疗手段。放眼整个脑疾病研究和精准医疗的未来,正是因为越来越多新技术的应用,让越来越多人看到了疾病治疗的春天。
参考文献:
[1] Gustavo Morrone Parfitt,Elena Coccia,et,al.Disruption of lysosomal proteolysis in astrocytes facilitates midbrain organoid proteostasis failure in an early-onset Parkinson’s disease model,Nature Communications,10 January 2024, DOI:10.1038/s41467-024-44732-2
[2]Jeffrey S. Schweitzer, Bin Song,et,al.Personalized iPSC-Derived Dopamine Progenitor Cells for Parkinson’s Disease,the New England Jouranl of menicine,14 May 2020,DOI: 10.1056/NEJMoa1915872
[3] Michael S. Haney, ProfileRóbert Pálovics,et,al.APOE4/4 is linked to damaging lipid droplets in Alzheimer’s microglia,Nature,13 March 2024,https://doi.org/10.1101/2023.07.21.549930
声明:登载此文出于传递更多信息之目的,并不意味着赞同其观点或证实其描述。文章内容仅供参考,读者据此操作,风险自担。
企业资讯










